【Kiwa总部公告】欧盟委员会设定目标:到 2024 年第二季度全面运行EUDAMED
发布时间:2022-12-01|
作者:BCC编辑|
文章来源:原创
什么是EUDAMED?
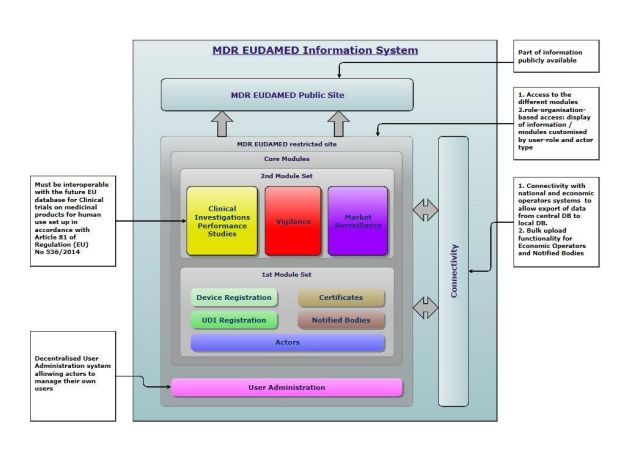
EUDAMED(欧洲医疗器械数据库)是欧盟委员会为实施欧盟医疗器械法规〔医疗器械法规(MDR)2017/745和体外医疗诊断医疗器械法规(IVDR)2017/746〕而开发的IT系统。
EUDAMED将登记由欧盟27个成员国所授权使用的所有医疗器械,并允许国家医疗监管机构和设备制造商查询有关设备的授权使用、安全问题、召回、新法规等信息。
过渡期
EUDAMED全面运行后,医疗器械行业将被强制要求使用该系统,届时将有6或24个月的过渡期,这一较长的过渡期适用于UDI(医疗器械唯一标识)和设备注册、证书和公告机构模块。
EUDAMED 模块
EUDAMED整合了六个模块:
• 参与者 – 用户注册和管理
• UDI和设备注册
• 证书和公告机构
• 临床试验和性能研究
• 警惕和上市后监督
• 市场监管
新世纪检验认证有限责任公司
电话:400-016-9000
邮箱:post@bcc.com.cn
电话:400-016-9000
邮箱:post@bcc.com.cn
联系地址:北京市东城区广渠门内大街45号D座5层
联系我们
想咨询更多认证服务,请您填写下面表格,我们将在工作时间内回电!



 京公网安备11010102007586号
京公网安备11010102007586号