体系认证:企业必备资质
管理体系是从质量管理的概念发展起来的,并传承了质量管理的精华。过程方法、PDCA循环,风险思维等管理理念在管理体系中得到了充分体现。一个组织针对某个特定领域管理的深度和广度,会依据自身的需求来确定。当需要对一个特定领域实施系统化管理时,组织若按照一个特定管理体系标准的要求实施管理,这无疑是一种全面、有效和高效的选择。
本页涉及的认证服务中均有对应的《认证实施规则》,BCC拥有其最终解释权。任何组织及个人未经BCC许可,不得以任何形式全部或部分使用(法律要求除外)认证相关信息。如需获取相关实施规则请用以下方式联系获取:电话:010-58579316 邮箱:fwjs@kiwa.cn

体系认证
医疗器械质量管理体系
医疗器械是医疗卫生体系建设的重要基础,具有高度的战略性、带动性和成长性,其战略地位受到了世界各国的普遍重视,已成为一个国家科技进步和国民经济现代化水平的重要标志。
GB/T 42061-2022/ISO 13485:2016《医疗器械质量管理体系用于法规的要求》认证标准是专门用于医疗器械产业的一个完全独立的标准,它以医疗器械法规为主线,强调实施医疗器械法规的重要性,提出相关的医疗器械法规要求,确保医疗器械产品在设计、开发、生产、组装、运输、处置等所有阶段安全有效。
医疗器械质量管理体系认证适用于所有医疗器械制造商及零部件供应商、分包服务商及经销商。例如:医疗器械软硬件开发商、医疗器械材料供应商、医疗器械设计和制造商等。
随着我国医疗器械产品质量的不断提高,以及企业对国际市场准入相关政策、法规的深入了解,我国有越来越多的医疗器械产品进入一些市场准入门槛较高、竞争较激烈的地域,以技术含量高、使用方便、更加安全有效的医疗器械新产品为支撑点的企业将有较强的竞争力!
认证流程
管理体系相关认证的流程基本一致,企业申请时不需要特别记录。流程一般包括:提交申请、签订合同和交预付款;初审(第一阶段审核/文件审查,第二阶段审核/现场审核);认证决定;结算费用,注册发证;每年的监督审核(次数略有不同);证书期满后的再认证等环节。
如图所示:
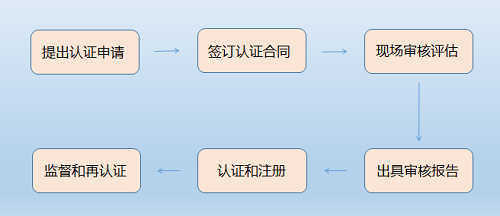
认证流程图
认证范围
根据IAF MD 9:2017《强制性文件 ISO/IEC 17021 应用于ISO13485 医疗器械质理管理体系》要求,并参考中国大陆地区《医疗器械分类目录》编制。
ISO13485认证范围分类
非有源医疗设备;
有源(非植入)医疗器械;
有源(植入)医疗器械;
对医疗器械的灭菌方法;
体外诊断医疗器械;
医疗器械有关服务;
ISO13485管理体系认证合同的受理范围
1、受审核组织认证范围必须是在UKAS认可的范围内;
2、归属于国内食药局发布的《医疗器械分类目录》内的认证产品,需提供国内医疗器械的产品/生产/经营备案凭证或注册证,方可受理;
3、不属于国家药监局发布的《医疗器械分类目录》内,且产品仅供外销的,能提供在相应的出口国按照医疗器械管理的证明(例如出口欧洲的,能提供按照CE医疗器械指令检测的报告或CE证书;出口到美国的,能提供美国FDA医疗器械注册证等),方可受理。
4、如受审核组织认证范围所涉及的产品不属于上述3条款范围内,但组织能够提供相关证明文件(如:监管机构的证明)也可受理认证,但必须满足上述1条的要求。
5、对于医疗器械的配件企业,需提供医疗器械采购方的采购合同。
如果贵司要申请办理,可咨询我们,进一步了解情况!
申请条件
申请人应具有明确的法律地位;
申请人应具备相应的许可资质:
1、对于生产型企业,I类产品需提供医疗器械产品备案凭证以及生产备案凭证;II类及III类产品需提供医疗器械产品注册证和医疗器械生产企业许可证;
2、对于经营企业,经营II类产品的需要提供医疗器械经营企业备案凭证;经营III类产品的需要提供医疗器械经营企业许可证;
3、对于仅出口的企业,根据3月31日商务部、海关及药监局三部委的文件,出口医疗防疫物品在满足进口国要求的前提下还需要取得国内医疗器械产品注册证/备案凭证以及医疗器械生产企业许可证/备案凭证;
4、配件及服务企业:需要有关合同及协议
5、医疗器械注册人:需要注册人证书
申请人已经按照标准建立文件化的管理体系(包括质量手册、程序文件、内审资料、管理评审资料以及程序文件要求的其它相关表单);
认证申请前,管理体系至少有效运行三个月并进行了一次完整的内部审核和管理评审(对于生产植入性医疗器械产品,体系运行时间至少6个月,其他产品的管理体系至少运行3个月)。
如果贵司要申请办理,可咨询我们,进一步了解情况!
资料清单
认证组织需要提交的基本资料有:
1、法律地位证明文件(如企业法人营业执照、事业单位法人代码证书、社团法人登记证等);
2、有效的资质证明、产品生产许可证、强制性产品认证证书等涉及法律法规规定的行政许可的须提交相应的行政许可证件复印件(需要时);
申请企业的产品涵盖在国家医疗器械分类目录的,申请人应提交的资质证明具体如下:
1、对于生产型企业,提供产品注册证/备案凭证、医疗器械生产企业许可证/备案凭证;
2、对于经营企业,提供医疗器械经营企业许可证/备案凭证。
3、对于产品仅供出口的企业,不需要提供以上证件。但应提供满足出口国法规的证据。
如果贵司要申请办理,可咨询我们,进一步了解情况!
认证收费
为规范认证收费行为,保护认证双方的利益,本体系的收费标准详见《管理体系认证、服务认证收费规则》,请点击查看!
成功案例
湖南某医疗公司ISO13485认证审核
- 2020-08-03 南昌某医疗公司ISO13485认证二阶段审核
- 2020-08-03 温州某眼镜公司ISO13485认证一阶段审核
- 2020-08-03 山东某包装公司医疗器械认证一阶段审核
行业新闻
- 2020-04-13 疫情防控产品,如何在欧盟及美国上市?
- 2020-04-20 13485医疗器械质量管理体系和防疫产品标准培训举行
- 2020-04-17 口罩和防护服国内及欧美出口认证流程和最新变化
- 2020-04-17 口罩和防护服在国内及欧美的分类和要求







 京公网安备11010102007586号
京公网安备11010102007586号