培训服务:内外兼修,审行致远
聚焦内审员与外审员协同培养,打造全方位审核人才梯队。课程专为培育复合型审核人才设计,课程深度融合ISO管理体系核心标准与行业最新合规要求,系统提升学员的条款解读、证据溯源及风险预判能力。特邀国家级注册审核专家授课,配套权威认证考试通道,助力学员快速获得相关资质,同时也为企业可持续发展注入强效动能!

培训服务
MDR临床评价及技术文档培训
本课程是为期4天(2+2)的专业培训,课程将深入解析欧洲医疗器械法规(MDR)框架下的临床评价与技术文档的核心要求。
临床评价模块,课程将系统阐述这一确保医疗器械安全与性能的关键流程。临床评价作为预先规划的系统化评估过程,旨在验证医疗器械对MDR的合规性,并持续证明其风险收益比的可接受性。作为MDR要求的重要技术文件,临床评价报告在CE认证过程中具有决定性作用。本模块课程将深度解读MDR临床评价条款,结合典型案例,重点剖析临床数据收集方法与MDR临床评价的评审要点。
技术文档模块,课程将全面解析MDR 2017/745法规下的技术文档编制要求。通过本模块学习,您将掌握技术文档的详细编写规范,准确识别现有文档与MDR要求的差距,并制定切实可行的改进方案,确保技术文档的完整性和合规性。本模块课程将依据MDR最新要求进行重点讲解与指导。
本课程采用"理论讲解+案例分析+实操指导"的教学模式,旨在帮助学员全面提升MDR合规能力,为医疗器械产品顺利通过CE认证奠定坚实基础。
课程对象
本课程适用于医疗器械生产企业负责法规注册、研发、临床、售后监督、不良事件报告和质量管理体系的相关人员。
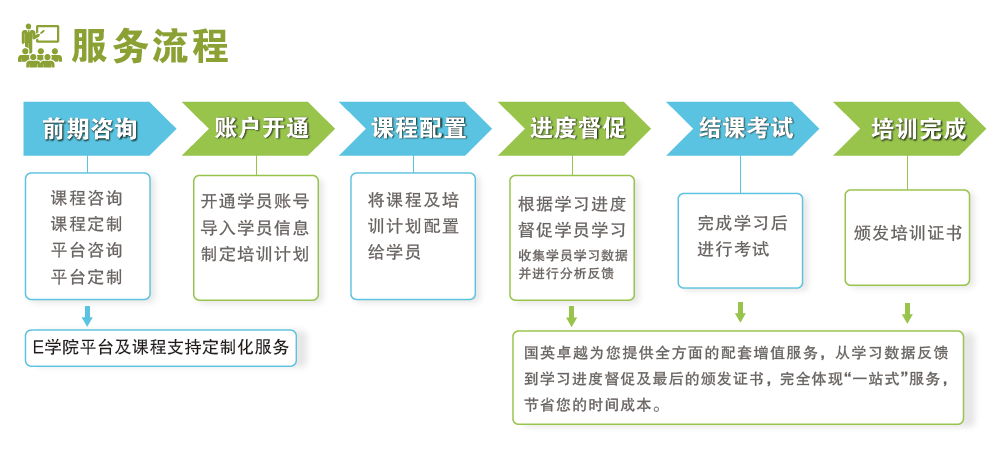
报名流程
课程大纲(Day 1-2)
主题:欧盟MDR临床评价深度解析与实践
模块一:临床评价基础与框架
临床评价概述:定义、目标与重要性
临床评价在医疗器械生命周期中的关键作用
临床证据的核心价值及其在MDR合规中的意义
模块二:临床评价流程与实施
临床评价的触发条件与实施时机
利益相关者角色与职责:制造商、公告机构、临床专家等
等同产品的使用原则与限制
模块三:临床数据管理
临床数据的类型与获取途径
数据收集、分析与评估方法 文献回顾流程:数据库选择、检索策略设计与关键词优化
数据审阅与问题定义:如何构建高效的文献检索框架
模块四:临床评估计划与报告(CEP/CER)
临床评估计划(CEP)的制定与关键要素
临床评估报告(CER)的结构与内容要求
CER编写流程与责任分工
模块五:SOTA与风险效益评估
最新技术水平(SOTA)的定义与应用
性能与安全性分析
风险-效益评估方法与实践
模块六:常见问题与案例分析
临床评价中的常见错误与规避策略
典型案例解析与经验分享
课程大纲(Day 3-4)
主题:欧盟MDR技术文档编写与审查实务
模块一:MDR技术文档框架与审查流程
MDR技术文档的结构与核心要求
文档审查流程:形式审查与内容审查
模块二:技术文档核心要素解析
通用安全与性能要求(GSPR)文件编写与审查
器械描述文件的关键内容与合规要点
制造商提供信息的规范与审查标准
模块三:产品设计与制造文档
产品设计文件的合规性要求
制造过程文件的编制与审查
持续改进管理体系的构建与实施
模块四:风险管理与临床前测试文档
风险管理文档的编写与审查要点
临床前安全性能测试报告的合规性要求
生物相容性研究资料的准备与审查
模块五:专项研究资料审查
可用性研究资料的编写与审查
灭菌确认资料的合规性要求
包装运输验证资料的准备与审查
老化试验资料的要求与审查要点



 京公网安备11010102007586号
京公网安备11010102007586号