MDR 医疗健康 服务业务
发布时间:2024-04-11|
 |
| Kiwa如何为医疗器械行业提供服务 | |
| 医疗器械作为一类高度异质化的产品,涵盖了诸如主动医疗设备、植入物、可复用器械、医用物质与材料以及软件等多个细分领域,其设计初衷均在于服务人类健康。鉴于其直接关系到人们的生命健康,因此医疗器械的安全与性能至关重要。 欧盟医疗器械法规(Medical Device Regulation,以下简称MDR)是欧洲市场的准入法规医疗器械要在欧盟上市和交易,必须符合相关的欧洲法规。我们可以提供完整、可靠的信息来承担相应的医疗器械认证流程,并提供合格的合格评定活动和相关服务。 | |
| 提供优质服务 保障生命健康 | |
| 认证不仅关乎合规性标准,更在于建立信任。患者、医疗专业人士以及监管机构均高度依赖经过认证的医疗设备在安全性与有效性方面的保障。Kiwa致力于协助您树立并维护这种信任。 | |
|
Kiwa中国医疗团队创立于2009年,服务过超过500家医疗器械企业, 超过50名专职管理人员、现场审核员与技术专家。 |
|
 |
|
| Kiwa 是医疗器械的公告机构 |
|
| Kiwa Belgelenddirme Hizmtleri(Kiwa NB1984)做过数千种医疗器械产品的认证,其在医疗器械认证领域的实力和经验得到了广泛认可。 | |
| Kiwa 是 TEAM-NB 成员 | |
| Kiwa Cermet 意大利, Kiwa 土耳其,和Kiwa DARE 荷兰 是TEAM-NB 的成员,TEAM-NB是欧洲医疗器械领域公告机构协会。 | |
 |
|
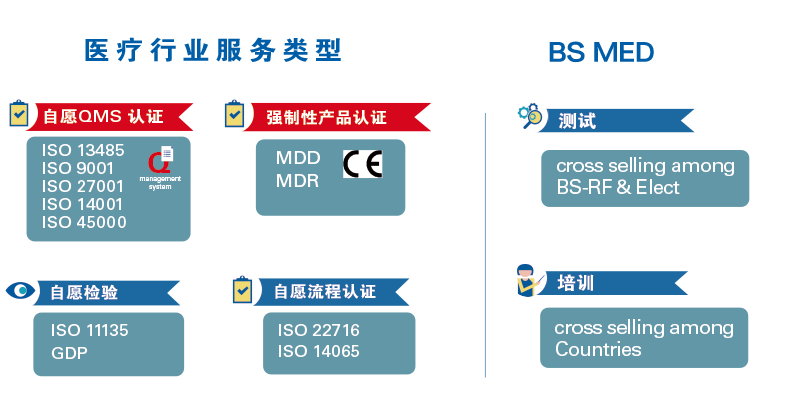
| 医疗器械合格评定 | |
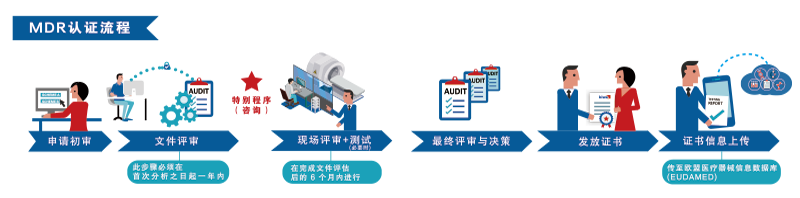
| Kiwa 医疗器械认证,通过其专业的公告机构,严格遵循欧盟法规(EU) 2017 / 745 (MDR),执行医疗器械的符合性评估活动,确保产品符合欧盟标准。得益于在全球多个国家拥有众多资深的专业人员,Kiwa 医疗器械认证具备在全球范围内提供全面、高效的评估活动的能力,以满足不同国家和地区的监管要求。 | |
| 根据欧盟法规的相关规定,获取欧盟符合性证书所遵循的程序严格依据医疗器械的风险等级进行差异化处理。对于第52条所述的I类无菌器械(Is)、具有测量功能的器械(Im)或可重复使用的手术器械(Ir),以及IIa、IIb和III类(包括定制植入式)医疗器械,由于其潜在风险较高,因此始终需要公告机构的参与和干预,以确保这些器械的安全性和合规性得到充分保障。这一程序的实施,旨在确保医疗器械的质量、安全和有效性,进而保护患者的权益。 | |
| ISO 13485 医疗器械质量管理体系 | |
| 人们的生存离不开医疗设备,因此,如果您的企业涉足医疗器械领域,确保质量至关重要。ISO 13485 认证将助您证明,您具备向客户提供符合法规要求和客户期望的医疗器械及相关服务的能力。 | |
| ISO 13485 明确界定了医疗器械行业运营组织所需遵循的质量管理体系要求。Kiwa作为获得国际广泛认可的管理体系认证机构,是您在遵循和实施 ISO 13485 标准方面的可靠伙伴和值得信赖的合作伙伴。 | |
| 我们的全球医疗服务业务 | |
| 我们深知,确保您的医疗器械符合行业标准和法规要求对患者安全和市场经营至关重要。凭借超过25年的业务实践中,我们已成功助力数千款设备通过认证,在医疗领域积累了广泛而深厚的经验。Kiwa拥有遍布全球的办事处和实验室网络,我们将确保在您的任何运营地点提供及时、专业的支持服务,帮助您轻松驾驭国际市场。 | |
| Kiwa致力于提供全面且可靠的信息,确保医疗器械认证流程的严谨性,并开展可信赖的合格评定活动及相关服务。我们传递信任。 | |
 |
|
| MDR 产品范围涵盖 | |
| 有源诊断,有源治疗,骨科植入物,牙科植入物,功能植入物,动物源器械,带药器械,可吸收器械,Annex XVI非专业用医疗器械,耗材等。 | |
 |
|
| Kiwa官方在全球针对MDR的详细介绍: | |
| https://www.kiwa.com/en/service2/certification/marking-ce-mdr-medical-devices/ |
新世纪检验认证有限责任公司
电话:400-016-9000
邮箱:post@bcc.com.cn
电话:400-016-9000
邮箱:post@bcc.com.cn
联系地址:北京市东城区广渠门内大街45号D座5层
联系我们
想咨询更多认证服务,请您填写下面表格,我们将在工作时间内回电!



 京公网安备 11010202009534号
京公网安备 11010202009534号